|
|
 |
 |
|
|
Wolfgang Marks: Die Formatierte DNA
|
|
|
Die Nutzung genomischer Schlüssel
führt zu definierten Nukleosomengrössen.
Kann man diese Nukleosomengrössen berechnen?
Aus der Anordnung der Basen in der DNA lassen sich unmittelbar keine Rückschlüsse auf die Anordnung der Nukleosomen ziehen. Es gibt zwar Hinweise in der Literatur, dass bestimmte DNA-Motive von Nukleosomencores (Histon-Oktameren) offenbar bevorzugt besetzt werden, daraus lassen sich aber keine Regeln für eine phasengetreue Formatierung mit definierten Nukleosomengrößen ableiten.
Fast 20 Jahre lang habe ich auf den verschiedensten Wegen versucht, die von mir schon 1990 postulierten distinkten Nukleosomengrößen zu berechnen. Alle Details dieses Prozesses hier zu beschreiben, ist zum einen aus Platzgründen nicht möglich, zum anderen zu diesem Zeitpunkt vom Autor auch nicht gewollt. Nur soviel sei hier gesagt: Anfangs waren meine Berechnungen mangels einer ausreichend breiten Datenbasis sehr ungenau, was sich auch in meiner eingangs erwähnten Arbeit von 1990/91 zeigt. Vor allem fehlte in meinen Überlegungen der 90/91er Jahre ein wesentlicher Faktor, den ich erst verifizieren konnte, als das Human Genome Project das erste „build“ veröffentlichte.
Nach vielen Rechenläufen mit den unterschiedlichsten mathematischen Reihen und -Modellen kam ich rasch zu der Überzeugung, dass Nukleosomengrößen zum einen gerade Zahlen sein, zum anderen sich jeweils um den Wert vier unterscheiden müssten, da ja auch der genetische Code aus vier verschiedenen Basen gebildet wird. Letztlich brachte aber erst die Entdeckung der REMAKEs39 sowie der Netzwerksysteme von Promotoren und Antisense-Promotoren, welche die Aktivierung und die Transkription von ALU- und REMA-Genen40 steuern und die Übertragung logischer und syntaktischer (Sprach)Strukturen auf das humane Genom den Erfolg. Nachdem ich diese (und andere) Konstanten und Überlegungen bei meinen Berechnungen berücksichtigt hatte, ermittelte ich für das humane Genom die folgenden 23 Werte als mögliche und wahrscheinliche Nukleosomengrössen:
150
176-180-184-188-192-196-200
204-208-212
216-220-224-228-232-236-240-244-248-252-256-260
Von diesen 23 Nukleosomengrössen bezeichne ich die Werte 176 – 200 und 216 – 260 als transkriptionsaktive Nukleosomengrössen, weil sie direkt mit der Expression von Genen über die Ansteuerung von Promotoren und Terminatoren verknüpft sind. Die Zahl 150 steht aktuell für ein Genformat, das von der eukariotischen Zelle nur noch für die persistente Inaktivierung von DNA-Abschnitten genutzt wird und mit der Bindung von H1 verbunden ist. Die Grössen 204, 208 und 212 dagegen sind Markierungsgrössen. Dazu werde ich später noch detaillierte Ausführungen machen.
Die Aufzählung folgt der Nutzung bzw. Aktivierung dieser Nukleosomengrößen während der Phylogenese und der Ontogenese: die Nukleosomengröße 176 ist also wahrscheinlich das älteste – 260 das jüngste evolutionär entwickelte Genformat.41 176 ist demnach auch die kleinste – 260 die grösste (derzeitige) Zahl von Basenpaaren, die ein Nukleosom nach meiner Definition42 bilden können. Es sind zugleich die beiden Werte, die ich weiter oben zum einen als Summe der DNA- und Histon-Modifikationen an den canonischen Histonen (176), zum anderen als Summe der Modifikationen an DNA und Histonen insgesamt (260) genannt habe. Die Nukleosomengrösse 150 eingeschlossen habe ich also 23 gültige Werte errechnet – dies entspricht zufällig (?) auch der Zahl der menschlichen Chromosomen (einfacher, haploider Satz) und der Zahl der Buchstaben unseres Alphabets, wenn man „J“ und „I“ sowie „C“, Q und „K“ als einen Buchstaben rechnet. Aber auch dies ist sicher nur Zufall.
Unterstellt, dass es ein arithmetisches System von 19 transkriptionsrelevanten distinkten Nukleosomengrößen gibt – ein System, das Sense-Promotoren, Antisense-Promotoren, poly-A-Signale, locus control regions (LCR) und andere regulative Sequenzen auf einer arithmetischen Basis logisch miteinander verknüpft, dann ist es aus verschiedenen Gründen, auf die ich später noch zu sprechen komme, auch logisch anzunehmen, dass es innerhalb dieses Arrays von Werten Nukleosomengrößen gibt, die keine transkriptionsaktivierende, sondern eine transkriptions-inhibierende oder -modulierende Funktion haben.
Wie jeder halbwegs informierte Computernutzer weiß, werden Elemente einer Datei, die kopiert, gelöscht oder neu formatiert werden sollen - zunächst markiert und erst in einem zweiten Schritt verändert. Wenn sich dieses Bild auch nicht einfach auf die Vorgänge bei der DNA-Formatierung übertragen lässt, hat mich die Kenntnis dieser Vorgänge (und der Arbeit von Henikoff et al.43) doch zu der Annahme geführt, dass die Zelle bei der Neuformatierung der DNA zum Zweck der Differerenzierung oder bei der Übernahme vorhandener Muster bei der Proliferation oder beim Inaktivieren („löschen“) von DNA-Sequenzen auch nicht anders vorgeht wie ein Programmierer, der die Anweisungen für ein Betriebssystem zu schreiben hat, das die Befehle „neuformatieren“, „kopieren“ oder „löschen“ ausführen soll: die betroffenen Sequenzen oder DNA-Abschnitte werden, bevor die geplanten Aktionen ausgeführt werden, durch die Zelle zunächst markiert.
Für diese Markierung, die für jede der auszuführenden Aktionen spezifisch sein muss, bedient die Zelle sich bestimmter Nukleosomengrössen, die von denen, die mit der Aktivierung der Transkription verknüpft sind, verschieden sind. Erst in einem zweiten Schritt werden die derart markierten DNA-Abschnitte – dem epigentischen Programm der Zelle folgend – kopiert, neuformatiert oder stillgelegt (gelöscht).
Die Notwendigkeit einer spezifischen Nukleosomengrösse, mit deren Hilfe diejenigen DNA-Abschnitte zunächst markiert werden, die im Zuge der Differenzierung mit einer anderen Nukleosomengrösse formatiert werden sollen, ergibt sich allein schon aus der Unmöglichkeit, den physiologischen Prozess der Markierung und der Neuformatierung eines oder mehrerer DNA-Abschnitte in einem einzigen Zellzyklus unterzubringen. Auch darauf werde ich später noch zurückkommen.
Dass es in einem Modell der Formatierten DNA für die Inaktivierung von DNA-Abschnitten und damit den Genen darin eine Nukleosomengrösse geben muss, die sich von den transkriptionsaktivierenden unterscheidet, ergibt sich ebenfalls logisch aus dem System.
Dass es auch für das Kopieren der Nukleosomenkonfiguration eines bestimmten DNA-Abschnitts bei der Differenzierung einer Zelle eine besondere Nukleosomengrösse geben muss, ergibt sich zwingend aus der Tatsache, dass es sonst zur endlosen Wiederholung einer bestimmten Nukleosomengrösse kommen würde (bei Informatikern als Endlosschleife bekannt und gefürchtet). Dazu werde ich später im Kapitel über das Chromatin-Remodeling noch einiges sagen.
Ich habe deshalb den erwähnten drei Aktionen in meinem System jeweils eine spezifische Nukleosomengrösse44 und eine spezifische Funktion zugeordnet:
Die Nukleosomengröße 204 bedeutet: markieren für
„Format des Abschnitts ändern“
Die Nukleosomengröße 208 bedeutet: markieren für
„DNA-Abschnitt stillegen“
Die Nukleosomengröße 212 bedeutet: markieren für
„Format des Abschnitts kopieren“
Diese Zu- und Einordnung scheint mir nicht nur logisch, sondern auch unter phylogenetischen Aspekten sinnvoll zu sein: denn am Beginn der zellulären Evolution stand zweifellos eine Urzelle, die - wie jede einzelne Zelle des menschlichen Körpers auch heute noch - ständigen Mutationen aus den unterschiedlichsten Ursachen unterworfen war. Diese Mutationen führten zu Veränderungen im Genom, die bei der Teilung/Vermehrung an die Nachkommen weitergegeben wurden. Eine solche Veränderung konnte sich als lebensfördernd oder lebensfeindlich erweisen – sie setzte sich durch oder sie wurde eliminiert. Weil biologische45 Evolution also letztlich auf dem Experimentieren mit Veränderungen beruht, habe ich für die Nukleosomengrössen 204, 208 und 212 die Reihenfolge „ändern“ – „stillegen“ – „kopieren“ gewählt.
Nukleosomengrössen sind mit spezifischen Formatierungshormonen –
darunter Releasinghormonen - verknüpft.
Die Ontogenese des menschlichen Körpers beruht (nach einer Phase, in der die Entwicklung der Zygote zur Morula von maternalen Faktoren bestimmt wird) auf dem Austausch von Signalen zwischen den Zellpopulationen des sich entwickelnden Organismus. Diese Signale werden durch eine große Zahl verschiedener Botenstoffe übermittelt, die man grob in Wachstumsfaktoren, Hormone und Neurotransmitter einteilen kann. Während Hormone den Signalaustausch zwischen Organen und Geweben vermitteln, dienen Wachstumsfaktoren vor allem in den frühen Phasen der Entwicklung primär der direkten Interaktion zwischen einzelnen Zellen und Zellpopulationen und bestimmen in dieser Zeit die morphische Transformation der Einzelzelle und der Zellpopulation. Neurotransmitter sind Botenstoffe des Nervensystems, welche die Kommunikation zwischen Nervenzellen regeln, in dem sie Signale weiterleiten oder ihre Weiterleitung hemmen und haben eine eng begrenzte, lokale Wirkung. Neben den aufgezählten Botenstoffen gibt es weitere, zum Beispiel die Pheromone, die aber für diese Arbeit zumindest im Augenblick nicht von Interesse sind.
Ich habe versucht, die von mir berechneten Nukleosomengrössen in einen systematischen Zusammenhang mit dem Hormonsystem des menschlichen Körpers zu bringen. Wie wir wissen, ist das humane Hormonsystem hierarchisch organisiert: so führt die Ausschüttung von TRH im Hypothalamus zur Sekretion von TSH (Thyreotropin, syn. Thyrotropin; thyroidea-stimulating-hormone) in der Adenohypophyse, dieses bindet an Rezeptoren in Schilddrüsenzellen und aktiviert eine ganze Reihe von Prozessen, an deren Ende unter anderem die Ausschüttung von T3 und T4 steht. Die Ausschüttung von CRH führt zur Synthese von ACTH und dieses wiederum aktiviert die Produktion von Glucokortikoiden (Kortison, Kortisol, Kortikosteron) in der Nebennierenrinde mit den bekannten physiologischen Folgen.
Sowohl TRH als auch CRH gehören zur Gruppe der sogenannten Releasing-Hormone, einer Gruppe von Hormonen, die von bestimmten Zeitpunkten an im Hypothalamus (bzw. im Hypothalamus-Hypophysensystem) gebildet werden. Sie heißen Releasing-Hormone, weil sie die Freisetzung anderer Hormone initiieren. Wieviele Releasinghormone es tatsächlich gibt, ist nicht bekannt oder umstritten. Einige der in der Literatur erwähnten Releasing-Hormone sind nicht chemisch definiert (PRH/PRF: Prolaktin-Releasing-Hormon/prolactin releasing factor zum Beispiel) und nur durch die ihnen zugeschriebenen Funktionen charakterisiert bzw. postuliert, bei anderen (Gn-RH: Gonadotropin-Releasing-Hormone, im englischsprachigen Raum als FSH/LH-RH bezeichnet) ist die Funktion ganz oder teilweise unklar (gibt es ein spezifisches Releasinghormon für FSH?). Auch unsere Kenntnis der Funktionen der Neuropeptide, die im Hypothalamus, der Hypophyse, in der Epiphyse (?) oder im ZNS gebildet werden, ist noch sehr unzureichend. Ebenso sind die Wechselwirkungen und Beziehungen zwischen den Hormonen oder Faktoren, die von Zellen der Adenohypophyse, Neurohypophyse, Epiphyse, des Hypothalamus, des Thymus oder des ZNS ausgeschüttet werden, in vielen Einzelheiten ungeklärt. Das liegt zum Teil darin begründet, dass es schwierig oder nahezu unmöglich ist, auf diesem Gebiet experimentell Daten zu gewinnen. Zu einem erheblichen Teil ist aber auch die einseitige nutzenorientierte Förderung wissenschaftlicher Projekte für einen Zustand verantwortlich, in dem die Suche nach den Grundlagen des Lebens nicht mehr die Basis allen Forschens, sondern nur noch geduldete Randdisziplin ist.
Wieviele Botenstoffe insgesamt an der Regelung der physiologischen Aktivitäten des entstehenden und des adulten menschlichen Körpers beteiligt sind, ist nicht genau gewußt. Einigermassen verlässliche Daten sind – wenn überhaupt – dann nur für den adulten Organismus zu erhalten.
Formatierungshormone sind mit der Entstehung von
Stammzellreihen und Entwicklungsabschnitten der Ontogenese korreliert.
Da zu den in der Tabelle „Das Nukleosomengrössen- und Stammzell-System “ aufgeführten 19 Hormonen auch die zuvor erwähnten Releasinghormone gehören, hätte es nahe gelegen, alle dort aufgeführten Hormone unter diesen Begriff zu subsumieren. Da die Releasinghormone aber sowohl sprachlich als auch physiologisch bereits sehr eng mit dem Hypothalamus-Hypophysensystem verknüpft sind und die hier vorgestellten Botenstoffe auch von anderen Drüsen oder Zellen sezerniert werden, ziehe ich den Begriff „Formatierungshormon“ (engl. formatting factor oder formatting hormone) vor, da er weniger „vorbelastet“ und umfassender ist. Ausserdem beschreibt er die Funktion genauer als der etwas unscharfe Begriff „Releasinghormon“.
Das uns bekannte und zuvor skizzierte 3-stufige, kaskadierte Releasinghormon-System ist die letzte Stufe der Entwicklung eines komplexen Systems von Botenstoffen, an dessen Anfang mit einiger Sicherheit ein zweistufiges oder gar nur einstufiges System in den frühen Phasen der Entwicklung steht, also während der Morulagenese, der Blasto- und der Embryogenese.
Wie jedem Entwicklungsbiologen bekannt ist, lassen sich in der Ontogenese des menschlichen Organismus anhand verschiedener Parameter mehrere mehr oder weniger deutlich voneinander abgrenzbare Phasen unterscheiden. Solche Phasen sind zum Beispiel die 23 sogenannten Carnegiestadien, die einen differenzierten Blick auf die Entwicklung des Embryos vom befruchteten Ei bis zum Ende der Embryonalperiode erlauben.
Neben den Carnegiestadien lassen sich andere Entwicklungsabschnitte definieren, so zum Beispiel die bereits erwähnte Morulagenese, die Blastogenese (bis zum hatching, dem Schlüpfen aus der zona pellicuda), die eigentliche Embryogenese (beginnend mit der Einnistung der Blastozyste bis etwa zum 56.-60. Tag post conceptionem), sowie die sich anschliessende Fetogenese bis zur Fötusreife etwa am 200. Tag p.c.46 und die Adoleszenz, die man wiederum in mehrere Stufen unterteilen kann.
Das von mir hier vorgestellte neue Modell von Formatierungshormonen, das von der Verknüpfung bestimmter Nukleosomengrössen mit bestimmten Hormonen, mit Stammzellreihen47 und Entwicklungsstufen ausgeht, schließt die Gruppe der bislang bekannten (zweifelsfrei nachgewiesenen) Releasinghormone ein, erweitert diese Gruppe allerdings um eine Reihe von Hormonen, die nach dem Ergebnis meiner Studien und Überlegungen ebenfalls in diese Gruppe gehören.
Da der folgende Teil meiner Arbeit, „Entwurf eines programmatischen Nukleosomengrössen-und Stammzell-Systems“ in statu nascendi ist, sollte er auch cum grano salis betrachtet werden und als erster Versuch, das von mir postulierte und berechnete System von Nukleosomengrössen mit dem menschlichen Hormonsystem sowie mit der Ontogenese des menschlichen Organismus logisch und sinnvoll zu verbinden.
|
|
|
|
Entwurf eines programmatischen Nukleosomengrössen- und Stammzell-Systems.
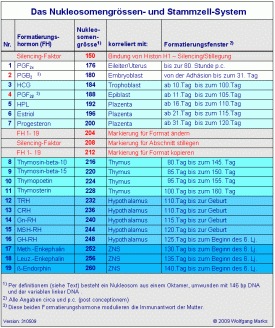 Ich habe die einzelnen von mir postulierten Formatierungshormone bestimmten Nukleosomengrößen, aber auch Organen, Zellen oder Drüsen zugeordnet, die diese Hormone als erste ausschütten oder mit ihrer Ausschüttung korreliert sind. Dabei gibt es eine zeitliche Hierarchie, die der Entwicklung der Formatierungs-hormone in der Phylogenese und ihrer Aktivierung während der Ontogenese folgt. Eine neue Stammzellreihe konnte nach dieser Theorie der formatierten DNA im Verlauf der Evolution immer erst dann entstehen, wenn ein neues Formatierungshormon zur Verfügung stand. Im Umkehrschluss können Hormone, Wachstumsfaktoren und andere Botenstoffe während der Ontogenese erst dann gebildet und sezerniert werden, wenn die entsprechenden Organe oder Zellpopulationen sich gebildet haben. Ich habe die einzelnen von mir postulierten Formatierungshormone bestimmten Nukleosomengrößen, aber auch Organen, Zellen oder Drüsen zugeordnet, die diese Hormone als erste ausschütten oder mit ihrer Ausschüttung korreliert sind. Dabei gibt es eine zeitliche Hierarchie, die der Entwicklung der Formatierungs-hormone in der Phylogenese und ihrer Aktivierung während der Ontogenese folgt. Eine neue Stammzellreihe konnte nach dieser Theorie der formatierten DNA im Verlauf der Evolution immer erst dann entstehen, wenn ein neues Formatierungshormon zur Verfügung stand. Im Umkehrschluss können Hormone, Wachstumsfaktoren und andere Botenstoffe während der Ontogenese erst dann gebildet und sezerniert werden, wenn die entsprechenden Organe oder Zellpopulationen sich gebildet haben.
Die Festlegung der in der Spalte „Formatierungsfenster“ angegebenen Zeiten und die Zuordnung der einzelnen Formatierungs-/Releasinghormone zu bestimmten Nukleosomengrössen sind zwar im Moment (noch) hypothetisch, erfolgten aber unter Berücksichtigung der neuesten Ergebnisse der Forschung, soweit sie in den Lehrbüchern der Endokrinologie, der Embryologie und der Entwicklungsbiologie oder im www zugänglich waren. Diese Fülle an Informationen oder die Quellen im Rahmen dieser Arbeit wiederzugeben, ist nicht möglich. Auch kann ich im Rahmen dieser Arbeit nicht alle Gedankengänge im Detail darlegen, die zu dieser Ordnung geführt haben. Auch das soll einer späteren erweiterten Veröffentlichung in Buchform vorbehalten sein.
Um Missverständnisse aber schon im Vorfeld zu vermeiden, weise ich ausdrücklich darauf hin, dass die angegebenen Zeiten für die Formatierung der DNA – für die Realisierung des epigenetischen Programms der Zelle - nicht identisch sind mit den Zeiten, in denen die aufgeführten Hormone oder Botenstoffe sezerniert oder Gene, die mit diesen Grössen formatiert wurden, exprimiert werden.
TRH zum Beispiel wird etwa ab dem 110. Tag p.c. gebildet und ist zunächst von diesem Tag an bis zur Geburt an der Formatierung der DNA in Zellen beteiligt, die in diesem Zeitraum einen Rezeptor für TRH aktiviert haben. Danach steuern die von TRH aktivierten primären und sekundären Transkriptionshormone (z.B. TSH als primäres, Parathormon als sekundäres) die Genexpression in Zellen, die Rezeptoren für diese Art von Transkriptionshormonen aufweisen - natürlich auch während der Adoleszenz und im adulten Organismus.
Die Zuordnungen in der Tabelle „Das Nukleosomengrössen- und Stammzell-System.“ und in der Grafik „Formatierungsfenster und epigenetische Prägung“ sind also ein Versuch, die Zeiten, in denen die Installation der epigenetischen Muster – die epigenetische Prägung - auf dem hier skizzierten und später noch detailliert beschriebenen Weg stattfindet, auf bestimmte Zeiträume einzugrenzen. Die in der Grafik „Formatierungsfenster und epigenetische Prägung“ aufgezeigten Entwicklungsstadien post partum sind natürlichen Schwankungen unterworfen und deshalb nicht mit einem bestimmten kalendarischen Alter korrelierbar.
Der initiale Reset und die epigenetische Formatierungskaskade.
Die Formatierung eines Zellgenoms beginnt im Augenblick der Befruchtung der Eizelle zwar „de novo“, aber nicht „ab initio“ – geht sie doch von einem Status aus, der sich im Verlauf der Phylogenese in etwa 4 Milliarden Jahren etabliert hat. Denn sowohl Ei- als auch Samenzelle bringen ein Expressionsmuster in die „Ehe“ ein, das sich über eine lange Reihe von RNA- und DNA-Generationen vererbt und dabei stetig weiterentwickelt hat: beginnend mit der Vereinigung der beiden Zellkerne, beginnend mit den ersten Teilungen der Zygote werden also durch Formatierung definierter DNA-Abschnitte Zug um Zug die epigenetischen Muster realisiert, die für jede Stammzelle und jede Subpopulation dieser Stammzellen a priori definiert waren.
Damit dieses vererbte Expressionsmuster allerdings von neuem realisiert werden kann, muss zunächst die Programmierung sowohl des väterlichen als auch des mütterlichen Genoms gelöscht werden. Für das väterliche Genom ist ein solcher Prozess in Nature beschrieben48 worden: Durch aktive Demethylierung, die von Demethylasen im Zellplasma der befruchteten Eizelle ausgeht, wird die Programmierung des paternalen Genoms zumindest teilweise gelöscht.
Ob sich dieser Eingriff in das väterliche Genom auf die Demethylierung der DNA beschränkt oder ob es sich um eine umfassendere Veränderung des genomischen väterlichen Erbteils zum Beispiel durch Modifizierung auch von Histon-Proteinen handelt, ist meines Wissens bis heute nicht untersucht worden. Fest steht allerdings, dass die Vereinigung von Ei- und Samenzelle mit einem „Reset“, einer Zurücksetzung des vereinigten Genoms auf einen definierten initialen Status verbunden sein muss, denn nur von einem solchen Status aus ist eine progrediente Neuformatierung der embryonalen Zellen, der Start der von mir zuvor beschriebenen epigenetischen Formatierungskaskade, die Installation der epigenetischen Vererbungsmuster möglich.
Es müssen also auch am maternal vererbten Genom Veränderungen vorgenommen werden. Auch diese Veränderungen beruhen – so vermute ich zumindest – auf Demethylierungen, die allerdings in diesem Fall von (den zuvor demethylierten) paternal vererbten Genen ausgehen und für eine Zurücksetzung auch des mütterlichen Genoms auf einen initialen Status sorgen.
Ein kurzer Ausflug in die Entwicklungsbiologie.
Das nach dem Eisprung sich bildende corpus luteum49 produziert das Hormon Progesteron, das u.a. den Umbau der Gebärmutterschleimhaut steuert und diese auf die Einnistung des Embryos vorbereitet. Kommt es zur Einnistung des Embryos, bleibt das corpus luteum unter dem Einfluss des vom Trophoblast ausgeschütteten humanen Chorion-Gonadotropins (HCG) erhalten und wandelt sich in das Corpus luteum graviditatis um, das für eine ausreichende Progesteronproduktion sorgt, bis die Plazenta in der Lage ist, über ihren Trophoblast-Anteil etwa ab dem 31. Tag50 die Progesteron-Produktion selbst zu übernehmen.
Das Progesteron des Ovars aktiviert im Endometrium die Ausschüttung des maternalen Prostaglandins PGF2α, das als (externes) Formatierungshormon der frühen Phase neben PGB2, HCG und PGF2β die Entwicklung der Blastozyste zum frühen Embryo steuern.
Exkurs:
Der Embryo als Antigen oder warum die Immunantwort der Mutter
gegen den Embryo ausbleibt.
Die Zona pellucida, welche die Blastozyste zunächst umgibt, besitzt keine HLA-Antigene und stellt demnach für das Immunsystem der Mutter eine Art „biologische Tarnkappe“ dar. Für den mütterlichen Organismus ist der Embryo aber spätestens vom Augenblick des hatchings51 und der Einnistung an ein Antigen – fremdes Gewebe, das es zu bekämpfen gilt, denn es trägt neben denen der Mutter auch HLA–Merkmale des Vaters. Dass der Embryo von den verschiedenen Organen des Blut- und Immunsystems der Mutter nicht als fremd erkannt und eliminiert wird, muss also auf einer nachhaltigen Veränderung des mütterlichen Immunsystems beruhen.
Nach Erkenntnissen des Autors ist das Ausbleiben der Immunantwort der Mutter darauf zurück-zuführen, dass durch die Aktivierung der Hormone PGB2 und PGF2β durch den Embryo im Körper der Mutter die Generierung und Prozessierung spezifischer Primärtranskripte aktiviert wird. Dadurch kommt es zur Bildung schwangerschaftsspezifischer Formen bestimmter Komplementkomponenten52 und damit zur Blockierung der T-Zell vermittelten Immunantwort, die gegen Antigene des Embryos gerichtet ist. Die Immunantwort der Mutter wird also zeitgleich mit der Entwicklung der embryonalen Antigene zielgerichtet moduliert.
Es ist also der erste Kontakt mit dem Endometrium des mütterlichen Uterus um die 80. Stunde herum, der die Formatierungs- und Hormonkaskade in der zu diesem Zeitpunkt 19-zelligen Morula – dies entspricht 19 pluripotenten Stammzellen – und die Differenzierung zur Blastozyste in Gang setzt. Nach dem hatching, das ziemlich genau am Ende des 6. Tages (140. h) stattfindet - von diesem Augenblick an ist der Embryo für den mütterlichen Organismus ein fremdes Antigen - aktiviert der Embryoblast das Prostaglandin PGB2, das neben dem Prostaglandin PGF2β die im obigen Exkurs beschriebene Modulation des mütterlichen Immunsystems induziert und damit die Abstoßung des „Fremdimplantats“ verhindert.
Da die Prostaglandine ebenso wie die anderen Arachidonsäure-Abkömmlinge53 (Eicosanoide) zu den phylogenetisch ältesten Botenstoffen gehören, habe ich sie mit dieser Phase der Entwicklung verbunden. Vielleicht findet sich ja ein Embryologe oder Reproduktionsgenetiker, der diesen Hinweis aufgreift. Bei Unfruchtbarkeit der Frau oder mehrfach fehlgeschlagener Implantation sollte man die Ursache vielleicht auch einmal bei den Prostaglandinen PGF2α, PGB2 oder PGF2β suchen.
Die Organisation des Hormonsystems
Nach der Imprägnation54 der Eizelle wird die Entwicklung der Zygote zur Morula bis etwa zur 80. Stunde55 ausschließlich von Faktoren des maternalen Zytoplasmas gesteuert. Erst danach übernimmt das aus dem Endometrium des Uterus stammende Prostaglandin PGF2α die Steuerung - PGF2α stellt demnach in meinem Modell die „Initialzündung“ der Ontogenese dar – es startet die Formatierungskaskade, an deren Ende das beta-Endorphin des ZNS schließlich als letztes von 19 transkriptionsaktiven Formatierungshormonen steht.
Bis zur 80. Stunde der Morulagenese ist das Hormonsystem wahrscheinlich nur einstufig organisiert. Danach ist es zunächst zweistufig und besteht auf der hormonellen Ebene bis zum Beginn etwa des 110. Tages aus den Formatierungshormonen 1 (PGF2α) bis 11 (Thymosterin) und – zeitlich gestaffelt und sich zum Teil überlappend - aus Wachstumsfaktoren, Eicosanoiden und schliesslich Thymushormonen als primäre Transkriptionshormone.
|
|
|
|
|
Ab dem 31.Tag – nach Abschluss der Somitenbildung -. greifen bis zum 110. Tag neben den Wachstumsfaktoren auch Eicosanoide und Thymushormone in die Steuerung der Ontogenese ein - das System ist in diesem Stadium aber immer noch zweistufig und auf die Formatierungshormone 1 bis 11 beschränkt. Um den 80.Tag herum sind der Thymus und das T-Zell-System ausgereift – es beginnt die Thymusperiode, in der die Genexpression von den Formatierungshormonen 8 bis 11 gesteuert wird. Thymosin-ß-10, Thymosin-ß-15, Thymopoetin und Thymosterin steuern als Formatierungshormone vom 80. Tag an bis etwa zum 160. Tag die Prägung der T- Zellen des Blut- und Immunsystems auf das „Selbst“ - Thymosin-ß-10 und Thymosin-ß-15 sind darüberhinaus auch als primäre Transkriptionshormone an der weiteren Entwicklung des T-Zellsystems beteiligt, die mit dem Beginn der Pubertät beendet ist.
Die dreistufige56 differentielle Genexpression57 - die Expression der von mir polycistronisch genannten gestückelten Gene, die immer auch mit dem alternativen Spleißen von Primärtranskripten (hnRNAs, prä-mRNAs) verknüpft ist - beginnt also erst mit dem 110. Tag der Ontogenese. Von diesem Tag an übernehmen nach und nach die Formatierungs-/Releasinghormone des Hypothalamus- Hypophyse-ZNS-Systems die Steuerung der Genexpression in den nachgeordneten Drüsen und diese die Steuerung der Genexpression in den von ihren hormonellen Signalen abhängigen Effektorzellen.
Insgesamt besteht das humane Hormonsystem58 wahrscheinlich aus 141 (19+79+43) Botenstoffen. Ein Teil dieser Hormone übernimmt abhängig von der Entwicklungsstufe unterschiedliche Funktionen im Rahmen der Genexpression. So fungieren die Eicosanoide ziwschen dem 31. und dem 110. Tag zunächst als primäre Transkriptionshormone, um anschliessend als sekundäre Transkriptionshormone beim Spleissen von Primärtranskripten Dienst zu tun. Thymosin-ß-10 und Thymosin-ß-15 (FH Nr. 8 und 9) fungieren zwischen dem 80. und dem 145. bzw. zwischen dem 85. und 150. Tag zunächst zunächst als Formatierungshormone und sind dann vom 200. Tag (Fötusreife) bis zum Beginn der Pubertät als primäre Transkriptionshormone an der Steuerung der Genexpression beteiligt.
Ontogenese reminisziert die Phylogenese. Fast alle „hotspots“ der Ontogenese sind mit dem Auftreten eines neuen Formatierungshormons korreliert.
Die Entwicklung der zellulären Immunabwehr beginnt mit der Bildung der ersten Blutzellen im Dottersack am 12. Tag p.c. Die ersten Abwehrzellen (frühe Phagozyten) differenzieren sich aus diesen Ur-Blutzellen um den 16./17.Tag herum. Aus diesen frühen Phagozyten entwickeln sich sowohl die „Ur“-B-Zelle, die etwa am 60.Tag in das noch in der Entwicklung begriffene Knochenmark einwandert als auch die „Ur“-T-Zelle, die etwa zum gleichen Zeitpunkt in die Leber immigriert. Dort entstehen die Monozyten, aus denen sich die Makrophagen entwickeln und T-Zell-Vorläufer, aus denen nach ihrer Einwanderung in den Thymus etwa am 80. Tag das gesamte T-Zellsystem hervorgeht. Die Entwicklung des sekundären lymphatischen Gewebes findet zwischen dem 90. und dem 110. Tag statt – etwa am 110. Tag ist schliesslich auch das B-Zell-System ausgereift – die B-Zelle bildet jetzt auch IgM und IgD-Rezeptoren (differentielle Genexpression durch Spleissen der Transkripte!).
Die Entwicklung des Komplementsystems beginnt etwa zeitgleich mit dem Beginn der Fetogenese am 60. Tag und ist um den 110. Tag herum beendet. Es folgen Entwicklungsabschnitte, in denen Hypophyse, Hypothalamus und schließlich das ZNS soweit herangereift sind, dass sie mit der Ausschüttung von Formatierungshormonen in Form von Releasinghormonen oder Neurotransmittern beginnen und in die Entwicklung des Organismus eingreifen können.
Mit dem 140. Tag ist die Etablierung der Formatierungskaskade beendet. Wenn die letzten drei der 19 Formatierungshormone ihre „Arbeit“ aufnehmen, haben die Formatierungshormone 1 bis 7, welche die Embroygenese geprägt haben, ihre Tätigkeit schon wieder eingestellt.
Dieser kurzgefasste Überblick soll im Augenblick genügen, um wenigstens ansatzweise die Beziehungen aufzuzeigen zwischen den von mir postulierten Formatierungshormen und Formatierungsfenstern auf der einen und einigen markanten Eckdaten der Ontogenese auf der anderen Seite. In einer späteren Veröffentlichung will ich diese Beziehungen im Zusammenhang mit einer Darstellung der Genese des Stammzellsystems weiter verdeutlichen und vertiefen.
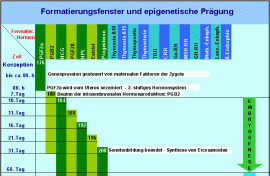 Formatierungsfenster während der Ontogenese Formatierungsfenster während der Ontogenese
Entwicklung des hierarchischen Stammzell- und Nukleosomensystems und der Verknüpfung dieses Systems mit Entwicklungsstadien während der Ontogenese.
Dieser kurzgefasste Überblick soll im Augenblick genügen, um wenigstens ansatzweise die Beziehungen aufzuzeigen zwischen den von mir postulierten Formatierungshormonen und Formatierungsfenstern auf der einen und einigen markanten Eckdaten der Ontogenese auf der anderen Seite. In einer späteren Veröffentlichung will ich diese Beziehungen im Zusammenhang mit einer Darstellung der Genese des Stammzellsystems weiter verdeutlichen und vertiefen.
|
|
39REMAKEs sind eine vom Autor entdeckte und benannte spezifische Klasse von SMARs am Anfang einer Domäne, die Bindestellen (docking-stations) für remodeling-Maschinen enthalten.
40Siehe die Kapitel über REMA- und ALU-Gene
41Ich habe einige Zeit darüber nachgedacht, ob ich die Nukleosomengrössen aufsteigend oder absteigend darstellen soll. Für eine Theorie der Formatierten DNA ist diese Frage im Grunde nebensächlich, da die postulierten mathematischen Beziehungen zwischen den Komponenten, die an der Genexpression beteiligt sind, durch eine andere Anordnung der Reihe unberührt bleiben. Lediglich die Zuordnung der Formatierungshormone zu den Nukleosomengrössen würde sich ändern.
42Ich definiere das Nukleosom als Einheit aus Nukleosomencore (146 bp an das Oktamer gebunden) und der linker-DNA (einer definierten Zahl von Nukleotiden bis zum nächsten Nukleosomencore).
43Henikoff,S., Furuyama,T., and Ahmad,K. (2004). Histone variants, nucleosome assembly and epigenetic inheritance. Trends Genet. 20, 320-326.
44Für diese Zuordnung gilt die gleiche Anmerkung, die ich bei der Definition der Nukleosomengrössen gemacht habe.
45Mit dem Begriff „biologische“ Evolution will ich andeuten, dass es auch eine geistige Evolution gibt.
46post conceptionem – nach der Empfängnis
47Ursprünglich war in dieser Arbeit auch ein Stammzellteil enthalten. Aus verschiedenen Gründen, die ich jetzt nicht im Einzelnen darlegen will, habe ich davon abgesehen, diesen (ziemlich umfangreichen) Teil jetzt schon zu veröffentlichen.
48Mayer W., Niveleau A., Walter J., Fundele R., Haaf T. (2000): Demethylation of the zygotic paternal genome. Nature 403, 501-502.
49der Gelbkörper
50Nach neueren Untersuchungsergebnissen bildet die Plazenta bereits ab dem II. Schwangerschaftsmonat Progesteron
51Hatching (engl.) – das Schlüpfen der Blastozyste aus der zona pellicuda, oft auch als zweite Geburt bezeichnet.
52Dass eine Schwangerschaft einen Einfluss auf das Immunsystem der Mutter hat, kann man nicht zuletzt daran erkennen, dass die Schwangerschaft bei Multiple-Sklerose-Patientinnen einen Einfluss auf die Häufigkeit und Schwere der Schübe und deren Regression hat (Int. MS Journ., 2003 Jun; 10(2):38-4
53die Leukotriene und Thromboxane
54Eindringen einer Spermie in die Eizelle; Befruchtung
55Von diesem Zeitpunkt an entwickelt sich die Morula zur Blastozyste.
56Das bedeutet, dass die Hormonkaskade dreistufig ist. Die Genexpression in einer definierten Zelle ist immer einstufig oder zweistufig gesteuert.
57Ich verwende den Begriff differentielle Genexpression im eigentlichen, sehr engen Sinn: ein Gen wird dann differentiell exprimiert, wenn von diesem einen Gen verschiedene mRNAs und damit Genprodukte generiert werden. Dies kann in der gleichen Zelle zu verschiedenen Zeiten unter verschiedenen Bedingungen geschehen, aber auch in verschiedenen Zellen zur gleichen Zeit. Differentielle Genexpression ist nach dieser Definition immer mit alternativem Spleissen einer oder mehrerer hnRNAs/prä-mRNAs verknüpft, die durch ein und dasselbe Gen kodiert werden.
58Dies ist ein Entwurf, der auf dem Studium vieler verschiedener Quellen und eigenen Untersuchungen und Überlegunggen basiert. Ich werde in Teil III die Interferenzen zwischen diesem System und den sogenannten Architekturproteinen des Chromatins aufzeigen.
|
|
|